Последние конференции
- Информационные системы и модели в научных исследованиях, промышленности, образовании и экологии
- Информационные системы и модели в научных исследованиях, промышленности и экологии
- Современные проблемы экологии
- Экологические проблемы окружающей среды, пути и методы их решения
- Экология, образование и здоровый образ жизни
Химический состав и биологическая активность буроугольных гуминовых веществ (разрез «Львовский» подмосковный бассейн)
Ю.Ю. Грачева, К.С. Лебедев
Российский химико-технологический университет им. Д.И.Менделеева
Новомосковский институт (филиал),
г. Новомосковск
Исследование и разработка химических препаратов на основе природного сырья (сапропелей, торфа, бурых углей) остается одной из наиболее актуальных проблем химии и ряда смежных с ней областей (сельское хозяйство, нефтехимия, медицина и т.п.) [1]. С этой точки зрения большой интерес представляют гуминовые вещества (ГВ), поскольку они содержат широкий спектр биологически активных соединений, обладают низкой токсичностью и не вызывают аллергических реакций при их применении [2].
Объектом исследования явились ГВ, выделенные из бурого угля разреза «Львовский» Подмосковного бассейна, основные физико-химические данные которого следующие: Wd 18.4; Ad 39.3 (масс. % от воздушно-сухого угля); элементный состав (масс. % daf): С 67.0 Н 59.3, N 1.55, O+S 59.5; рентгено-флуоресцентный анализ золы (масс. %): МgO – 0.49; Al2O3 – 44.80; SiO2 – 41.60; P2O5 – 0.18; SO3 – 2.76; CaO – 2.70; MnO – 0.06; Fe2O3 – 5.46; TiO2 – 1.06.
Выход гуминовых кислот (ГК) составил 19.4; фульвокислот (ФК) – 15.3, гиматомелановых кислот (ГМК) – 8.6 (масс. % от органической массы угля (ОМУ)).
Химический состав ГК, ГМК и гумина (ГМ) определяли с помощью традиционных методов химического анализа и ИК-Фурье, 1Н-ЯМР-спектроскопии.
Химический анализ был направлен на определение: фенольных гидроксилов (ФГ); йодного числа (ИЧ); хиноидных (ХГ); карбонильных (КГ) и карбоксильных (КрГ) групп. Молекулярная структура ГК, ГМК и ГМ была охарактеризована обобщением данных элементного, рентгено-флуоресцентного и количественного функционального анализов, криоскопии, ИК-Фурье и 1Н-ЯМР-спектроскопии.
Рентгено-флуоресцентный анализ ГК (масс. %): МgO – 0.62; Al2O3 – 35.94; SiO2 – 46.92; CaO – 0.48; MnO – 0.02; Fe2O3 – 2.53; TiO2 – 2.33; ГМК (масс. %): МgO – 0.88; Al2O3 – 5.14; SiO2 – 7.00; CaO – 0.90; MnO – 0.02; Fe2O3 – 0.45; TiO2 – 0.17; ГМ (масс. %): МgO – 0.71; Al2O3 – 36.50; SiO2 – 45.77; CaO – 0.76; MnO – 0.02; Fe2O3 – 2.42; TiO2 – 2.26. Как видно, минеральная часть ГК и ГМ отличается значительным преобладанием в ее составе SiO2, Al2O3, Fe2O3, TiO2.
Средняя молекулярная масса ГК, ГМК и ГМ (а.е.м.) составила 1809±10; 1659,1±10; 2072,1±10 соответственно. Элементный состав ГК (масс. % daf): С 43.36±0.20, Н 3.22±0.01, N 1.48±0.01, O+S 51.94±0.20; ГМК (масс. % daf): С 45.80±0.20, Н 4.60±0.01, N 1.72±0.01, O+S 47.88±0.20; ГМ (масс. % daf): С 42.07±0.20, Н 3.09±0.01, N 1.52±0.01, O+S 53.32±0.20. Функциональный состав ГК (мг-экв/г): ФГ 4.3±0.1; КрГ 0.7±0.1; ХГ 2.5±0.1; КГ 1.1±0.1; ИЧ 1.0±0.03; ГМК (мг-экв/г): ФГ 3.6±0.1; КрГ 0.8±0.1; ХГ 5.2±0.1; КГ 0.1±0.1; ИЧ 1.6±0.03; ГМ (мг-экв/г): ФГ 3.4±0.1; КрГ 0.6±0.1; ХГ 3.7±0.1; КГ 0.7±0.1; ИЧ 0.3±0.03.
На рис. 1 и на рис. 2, 3 представлены ИК-Фурье и 1Н-ЯМР спектры ГК, ГМК и ГМ. По характеристическим частотам полос поглощения ИК-спектров (ν, см-1) идентифицированы СН, СН2 ,СН3 группы (малоинтенсивные валентные колебания 3000-2750 см-1), С-СН3 (деформационные колебания 1460-1380 см-1); С=С (плоскостные колебания 1650 см-1), карбонильная (1740-1700 см-1), карбоксильная (валентные колебания 2600 см-1), ароматические СН (деформационные колебания 900-700 см-1). В спектрах 1Н-ЯМР - протоны алифатических структур, спиртов, эфиров, альдегидных, фенольных и карбоксильных групп, что полностью подтверждает результаты ИК-Фурье спектроскопии.
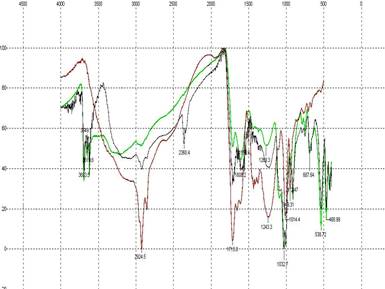
Рис. 1. ИК-Фурье спектры ГК, ГМК и ГМ
------ - гуминовые кислоты
------ - гиматомелановые кислоты
------ - гумин
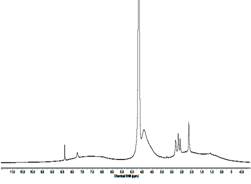
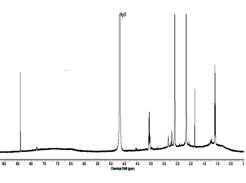
Рис. 2. 1Н-ЯМР спектр ГК Рис. 3. 1Н-ЯМР спектр ГМК
Биологическая активность ГП определялась с помощью дрожжевого теста. В качестве модельного организма были выбраны микроскопические грибы, относящиеся к биологическому виду Saccharomyces Cerevisiae (дрожжи верхового брожения) как один из наиболее изученных модельных организмов, на примере которого проводят исследование клеток эукариотов, легкодоступных и непатогенных для человеческого организма [3]. Результаты биотестирования ГП приведены в таблице.
Биологическая активность ГК и ГМК
|
Название вещества |
Концентрация вещества, % |
Объем выделившегося газа, выраженный в процентах к контролю | |
|
|
% | ||
|
ГК |
0,01 |
8,6 |
26 |
|
0,001 |
12,4 |
82 | |
|
ГМК |
0,01 |
11,9 |
75 |
|
0,001 |
12,5 |
83 | |
Можно видеть, что с изменением концентрации биологическая активность ГМК (по сравнению с ГК) практически не изменяется, что свидетельствует о наличии стабилизирующих факторов, в качестве которых, по-видимому, выступают хиноидные группы, число которых в ГМК в 2 раза выше, чем в ГК. Поэтому перспективность исследования ГМК, как основы для получения биологически активных препаратов, не вызывает сомнений.
Список литературы
1. Лиштван И.И., Абрамец А.М. Гуминовые препараты и охрана окружающей среды. Гуминовые вещества в биосфере. – М.: Наука, 1993. – 237 с.
2. Орлов Д.С. Гумусовые кислоты почв и общая теория гумификации. - М.: Изд-во МГУ. -1990. - 330 с.
3. И.В. Федько, М.В. Гостищева, Р.Р. Исматова. К вопросу об использовании биологически активных гуминовых веществ в медицине // Химия растительного сырья, 2005, № 1.